a) elektronski oblak π elektrona iznad i ispod ravni u kojoj se nalazi molekul vrlo je pristupačan, i drugi reagensi mogu lako da ga napadnu;
b) π elektroni nisu deo ugljenikovog skeleta, i π veza može lako da se raskine pri povoljnom sudaru sa reagensom, a da skelet C-atoma ostane nepromenjen;
c) π elektroni i elektroni reagensa mogu da nagrade dve nove sigma veze (ne remeti se skelet). Nastali proizvod je stabilniji od polaznog, jer su nastale dve sigma veze stabilnije od jedne π veze, i oslobađa se znatna količina energije.
ADICIONE REAKCIJE ALKENA
Za razliku od alkana, alkeni se odlikuju jakom adicionom moći, jer se dvoguba veza lako raskida, pa se na dve novoformirane veze mogu vezati drugi atomi ili atomske grupe. Kao proizvodi ovih reakcija postaju jedinjenja sa prostom vezom između C-atoma. Dvostruka veza je veoma osetljiva prema elektrofilnim reagensima, tj. takvim supstancama koje teže da prime elektrone, pa se zato reakcije adicije ubrajaju u elektrofilne adicije. Nezaićene veze služe kao izvori, odnosno donori elektrona, a elektrofilni reagensi primaju par elektrona i tako ostvaruju nove veze (elektrofilni reagensi su joni ili molekuli koji mogu da prime par elektrona).
1) ADICIJA VODONIKA. Alkeni lako adiraju vodonik u prisustvu katalizatora (platina, nikl ili paladijum) na običnoj temperaturi i pretvaraju se u alkane:

Na primer:
 Proces pri kome se vrši adiranje vodonika na neko jedinjenje vrlo često se naziva hidrogenizacija. Kada se hidrogenizacija vrši u prisustvu katalizatora, kao u navedenim primerima, često se naziva katalitička hidrogenizacija (katalitičko hidrogenovanje). Pri ovoj reakciji dolazi do stvaranja stabilnih alkana (sadrže manje energije od alkena) i vodonika, pa se zbog toga one vrše sa oslobađanjem toplote (kao egzotermna reakcija), koja se naziva toplota hidrogenizacije.
Proces pri kome se vrši adiranje vodonika na neko jedinjenje vrlo često se naziva hidrogenizacija. Kada se hidrogenizacija vrši u prisustvu katalizatora, kao u navedenim primerima, često se naziva katalitička hidrogenizacija (katalitičko hidrogenovanje). Pri ovoj reakciji dolazi do stvaranja stabilnih alkana (sadrže manje energije od alkena) i vodonika, pa se zbog toga one vrše sa oslobađanjem toplote (kao egzotermna reakcija), koja se naziva toplota hidrogenizacije. Pored navedenih metala koji se najčešće koriste kao katalizatori pri hidrogenizaciji (Pt, Ni, Pd), dosta se takođe upotrebljavaju rodijum (Rh) i rutenijum (Ru). Od katalizatora koji se koriste u reakcijama hidrogenizacije najselektivnija je platina, koja uglavnom daje cis-adicione proizvode. Paladijum sa druge strane ima manju stereoselektivnost uglavnom usled povećane sposobnosti da izomerizuje dvostruku vezu i pritom nastaju značajne količine trans-adicionog proizvoda. Katalitičke hidrogenizacije alkena pomoću platinskih katalizatora često su praćene premeštanjem dvostruke veze.

Adicija vodonika na alkene obuhvata tri faze:
Ovakav mehanizam ima za posledicu činjenicu da se u ovakvim reakcijama dobijaju molekuli kod kojih se dva adirana vodonikova atoma nalaze sa iste strane "bivše" dvostruke veze (pa je zbog toga adicija vodonika na alkene sin-adicija).
Adicija broma se izvodi na sledeći način: u sud sa nekim alkenom doda se malo rastvora broma u CCl4. Crvenomrka boja rastvora iščezava usled adicije broma. Na primer:

Međutim, upotrebom bromne vode dobija se znatno veća količina glikol-brom-hidrina nego 1,2-dibrom-etana:

Dobijeno jedinjenje CH2Br-CH2Br u prethodnoj reakciji možemo označiti kao adicioni proizvod etena (eten-bromid), ili kao supstitucioni proizvod etana (1,2-dibrom-etan).
Propen, na primer, adira brom dva puta brže od etena, izobuten 5,5 puta brže, a tetrametil-eten 14 puta brže.
Adicija hlora na alkene je slična adiciji broma. Na primer:

Ako se vrši adicija broma u vodenom rastvoru na nesimetrične alkene, brom se adira na manje supstituisani, a OH-grupa na više supstituisani C-atom. Na primer:

Adicija halogena na alkene najbolje se vrši na sobnoj temperaturi, ili pri hlađenju, u inertnim halogenovanim rastvaračima, kao što su halometani. Na primer:

3) ADICIJA HALOGENOVODONIKA.a) Elektrofilne jonske adicije. Alkeni adiraju halogenovodonike i grade zasićene halogenske derivate. Naročito lako adiraju bromovodonik i jodovodonik. Na primer:  Iako je u ovoj drugoj reakciji teorijski moguće i dobijanje 1-brom-propana, praktično se stvarno dobija 2-brom-propan.
Iako je u ovoj drugoj reakciji teorijski moguće i dobijanje 1-brom-propana, praktično se stvarno dobija 2-brom-propan.
Navedene reakcije imaju znatnu preparativnu vrednost, jer se na ovaj način nezasićeni prirodni proizvodi i alkeni, dobijeni iz nafte, pretvaraju u halogenske derivate alkana. 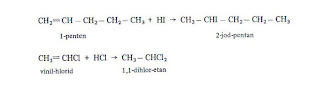 Adicija halogenovodonika, naročito kod viših alkena, kako je Markovnikov dokazao 1870. godine, vrši se tako što se halogen adira na ugljenikov atom sa najmanje vodonika – Markovnikovljevo pravilo (ovo pravilo je prvi put objavljeno 1905. godine, godinu dana posle smrti njegovog autora).
Adicija halogenovodonika, naročito kod viših alkena, kako je Markovnikov dokazao 1870. godine, vrši se tako što se halogen adira na ugljenikov atom sa najmanje vodonika – Markovnikovljevo pravilo (ovo pravilo je prvi put objavljeno 1905. godine, godinu dana posle smrti njegovog autora).
Navedena reakcija HCl i HI vrši se u skladu sa Markovnikovljevim pravilom.
b) slobodnoradikalske reakcije (reakcije po tipu radikala). Adicija HBr na alkene nije uvek jednaka čak ni kad se vrši pod istim uslovima. Na primer, pri adiciji HBr na alil-bromid mogu se dobiti dva proizvoda:  Prvi proizvod se postepeno gradi onda kada je alken čist i kada se reakcija vrši u tami (bez prisustva svetlosti) i u potpunom je skladu sa Markovnikovljevim pravilom. Međutim, ako alken nije sveže očišćen, ili ako je prisutan kiseonik, onda se gotovo potpuno gradi 1,3-dibrom-propan, pa je ovakva adicija u suprotnosti sa Markovnikovljevim pravilom. Ovo odstupanje od ovog pravila objašnjava se dejstvom peroksida pri adiciji HBr. Naime, kako je u novije vreme dokazano, prisustvo organskih peroksida utiče da pri ovoj adiciji dolazi do odstupanja od Markovnikovljevog pravila, iako brom koji se veže za ugljenik alkena bi hteo da formira minimalno stabilan centar karbokatjona. Reakcija obuhvata napadanje radikala broma proizvodeći radikal od nekog ugljenika alkena. Međutim, uklanjanjem peroksida ona se potpuno pokorava ovom pravilu. To se postiže dodavanjem inhibitora (na primer, hidrohinona). Prema tome, bromovodonik se adira na alkene prema Markovnikovljevom pravilu u odsustvu organskih peroksida, a u njihovom prisustvu adicija se vrši u obrnutom smislu.
Prvi proizvod se postepeno gradi onda kada je alken čist i kada se reakcija vrši u tami (bez prisustva svetlosti) i u potpunom je skladu sa Markovnikovljevim pravilom. Međutim, ako alken nije sveže očišćen, ili ako je prisutan kiseonik, onda se gotovo potpuno gradi 1,3-dibrom-propan, pa je ovakva adicija u suprotnosti sa Markovnikovljevim pravilom. Ovo odstupanje od ovog pravila objašnjava se dejstvom peroksida pri adiciji HBr. Naime, kako je u novije vreme dokazano, prisustvo organskih peroksida utiče da pri ovoj adiciji dolazi do odstupanja od Markovnikovljevog pravila, iako brom koji se veže za ugljenik alkena bi hteo da formira minimalno stabilan centar karbokatjona. Reakcija obuhvata napadanje radikala broma proizvodeći radikal od nekog ugljenika alkena. Međutim, uklanjanjem peroksida ona se potpuno pokorava ovom pravilu. To se postiže dodavanjem inhibitora (na primer, hidrohinona). Prema tome, bromovodonik se adira na alkene prema Markovnikovljevom pravilu u odsustvu organskih peroksida, a u njihovom prisustvu adicija se vrši u obrnutom smislu.
4) ADICIJA VODE. Voda ne reaguje sa alkenima, ali u prisustvu H2SO4 i njenih soli (od kojih se najčešće koristi živa(II)-sulfat) ili H3PO4 i soli sumporne kiseline, kao katalizatora, molekul vode se adira prema Markovnikovljevom pravilu. Uslov za ovu adiciju je veliki pritisak (6MPa). Ova hidrataciona reakcija vrši se tako što se vodonik iz vode adira na C-atom sa većim brojem H-atoma, a OH-grupa sa manje H-atoma:
 Na primer:
Na primer:

Za adiciju vode kažemo da je posredna reakcija, jer tek u drugom stepenu reaguje voda. U prvom stepenu ove reakcije dolazi do adicije katalizatora (H2SO4 ili H3PO4) na alken, i tako dobijeno jedinjenje u drugom stepenu adira vodu. Zapravo voda ne adira sa dobijenim jedinjenjem već dolazi do nukleofilne supstitucije pošto je za adiciju potrebna višestruka veza, a u jedinjenju dobijenom u prvom stepenu ove adicije nema višestruke veze. Krajnji proizvod je alkohol kao adiciono jedinjenje.
Postavlja se pitanje zašto je za adiciju vode potreban katalizator, dok za elektrofilnu adiciju bromovodonika nije potreban, iako su O-H veze polarnije od H-Br veza. To se objašnjava time da su O-H veze jače, tako da je više energije potrebno za njihovo raskidanje.
Navedene reakcije se upotrebljavaju za industrijsko dobijanje etanola, 2-propanola i 2-butanola.
REAKCIJE ALKENA SA FLUOROM
Alkeni reaguju eksplozivno sa fluorom. Pri ovoj reakciji se dobija ugljenik i gasoviti fluorovodonik. Ova reakcija nema ni teorijsku ni industrijsku primenu.

REAKCIJE ALKENA SA VODENIM GASOM
Reakcijom alkena sa smešom ugljen-monoksida i vodonika ("vodeni gas") pod pritiskom, u prisustvu kobalt-karbonila kao katalizatora, dobijaju se aldehidi. Na primer:

REAKCIJE POLIMERIZACIJE
Za ovaj tip reakcije alkena kažemo da je adicionog tipa jer je suština ove reakcije u adiciji između više istih ili različitih molekula koji pripadaju klasi alkena. Za polimerizaciju su potrebni određeni uslovi. Proizvodi polimerizacije su molekuli velikih molekulskih masa koji se nazivaju polimeri i predstavljaju jedan tip makromolekula. Ukoliko dolazi do adicije dva molekula iz klase alkena onda takvu reakciju nazivamo dimerizacija. U toku reakcije polimerizacije nema reakcionog ostatka, već nastaje samo jedan glavni proizvod reakcije. Molekuli iz koga nastaje polimer nazivaju se monomeri. Polimeri nemaju određenu molekulsku masu (nisu homomolekularni), već se sastoje iz molekula približno istih masa, zato se za njihove molekulske mase kaže da iznose oko nekog broja (za polieten oko 20.000). Svaki polimer dobijen polimerizacijom jedne vrste monomera ima karakteristične osobine koje su slične osobinama monomera. Ukoliko se polimerizuju dva različita molekula dobija se polimer kod kojeg su osobine jednog monomera modifikovane osobinama drugog. Polimerizacija pri kojoj dolazi do adicije dva ili više različitih vrsta polimera naziva se kopolimerizacija. Prilikom kopolimerizacije dolazi do kombinovanja osobina monomera, pa se ovakav postupak dosta koristi u industriji plastičnih masa, jer se mogu dobiti polimeri znatno boljih osobina, od osobina njihovih monomera. Ovaj tekst nije završen. Biće uskoro napisan tekst o inicijaciji, propagaciji i terminaciji, tj. o mehanizmu reakcije.

16 коментара:
posalji te mi sve na mejl treba mi za fax
senkice@gmail.com
Pozdrav Jelena!
Ako sam dobro razumeo,hoćeš da ti pošaljem ovaj tekst o hemijskim osobinama alkena na e-mail. Za to nema potrebe, jer sama možeš da ovaj (kao i sve ostale tekstove na blogu) skineš jednostavnim postupkom: selektuješ tekst ili deo teksta koji želiš da sačuvaš na svom kompjuteru, a zatim desni klik miša i izabereš opciju copy. Zatim u novom Word dokumentu klikneš desni taster miša i izabereš opciju past.
Ako te nisam dobro razumeo, molim te pojasni svoj komentar. :)
Tekstovi su zaista fenomenalni. Ja ucim sada polimerizaciju alkena, ali mi zaista nista ne ulazi u glavu. Primeri u mojoj knjizi(srednja skola) su zaista ``bedni``, tako da bih Vas zamolila da malo poradte na tome! Hitno je!
Pozdrav i svaka cast:-)!
GAGA
Pozdrav Gaga! Hvala na pozitivnim komentarima! Dobro poznajem udžbenik za srednju školu (ako misliš na onaj od Stojiljkovića koji je za ginaziju)jer i ja idem u srednju školu! :)
Tekst ću najverovatnije postaviti u nedelju. Biće najviše korišćen udžbenik za gimnaziju, udžbenik za fax i predavanje moje profesorice! Nadam se da će ti taj tekst pomoći!
Pozzz :)
Odlicno! Ma naucila sam sinoc,ali kad bolje razmislim i nije tako lose objasnjeno, nego ja nisam bas najbolje citala:-).Jeste taj udzbenik,iako ne idem u gimnaziju. U svakom slucaju PUNO HVALA i... SAMO NAPRED!
POZDRAV,
GAGA!
mozete li mi napisati izomere pentana i heksana?
da li možete da mi napišete adicije sa etenom??????? molim vas hitno mi treba
To već imaš napisano u tekstu "Hemijske osobine alkena" - vidi deo o adicijama. Mehanizam je isti samo što umesto alkena kog sam ja stavio u primer ti lepo staviš eten.
zasto je prvi clan alkena eten a nije meten... ? molimm te mi reci Stefane...
Zato što nije moguće formiranje dvosturke veze unutar metana. :) Za formiranje dvostruke veze u molekulu ugljovodonika su potrebna dva atoma ugljenika. :)
Napisite mi ako mozete strukturnu formulu palmitooleinske kiseline.
hvala
pozzzz
Evo ja bih da objasnim mehanizam adicije Br na alkene (dvostruku vezu)
u prisustvu FeBr3 dolazi do heterolitickog raskidanja veze u molakulu Br2 pri čemu nastaju bromonijum (Br+) i bromidni jon (Br-)
FeBr3 veže koordinativno-kovalentnom vezom Br- jon i nastaje FeBr4-.
Br+ jon se adira na = vezu i pi veza se raskida (zajednički elektronski par se premjesta na jedan od ugljenikovih atoma - Br+ ima praznu orbitalu) i nakon toga FeBr4- otpusta Br- jon koji se adira na drugi ugljenikov atom (ovaj put ugljenik ima praznu orbitalu) i tako se reakcija zavrsi.
eto toliko od mene
Da li zna neko adiciju vodonika na 2 buten? Unapred hvala?
Kako je formula za bromnu vodu?
moze li da mi gi kazete avtorite na knigite od koi sto e pisuvan tekstov? fala :)
SUPER!
Постави коментар